Tasectan
Rychle a bezpečně zkracuje dobu trvání průjmu, a to bez ohledu na původ průjmu. Tasectan současně omezuje doprovodné příznaky průjmu, jako jsou bolest břicha a časté stolice.
Tasectan je zdravotnický prostředek.
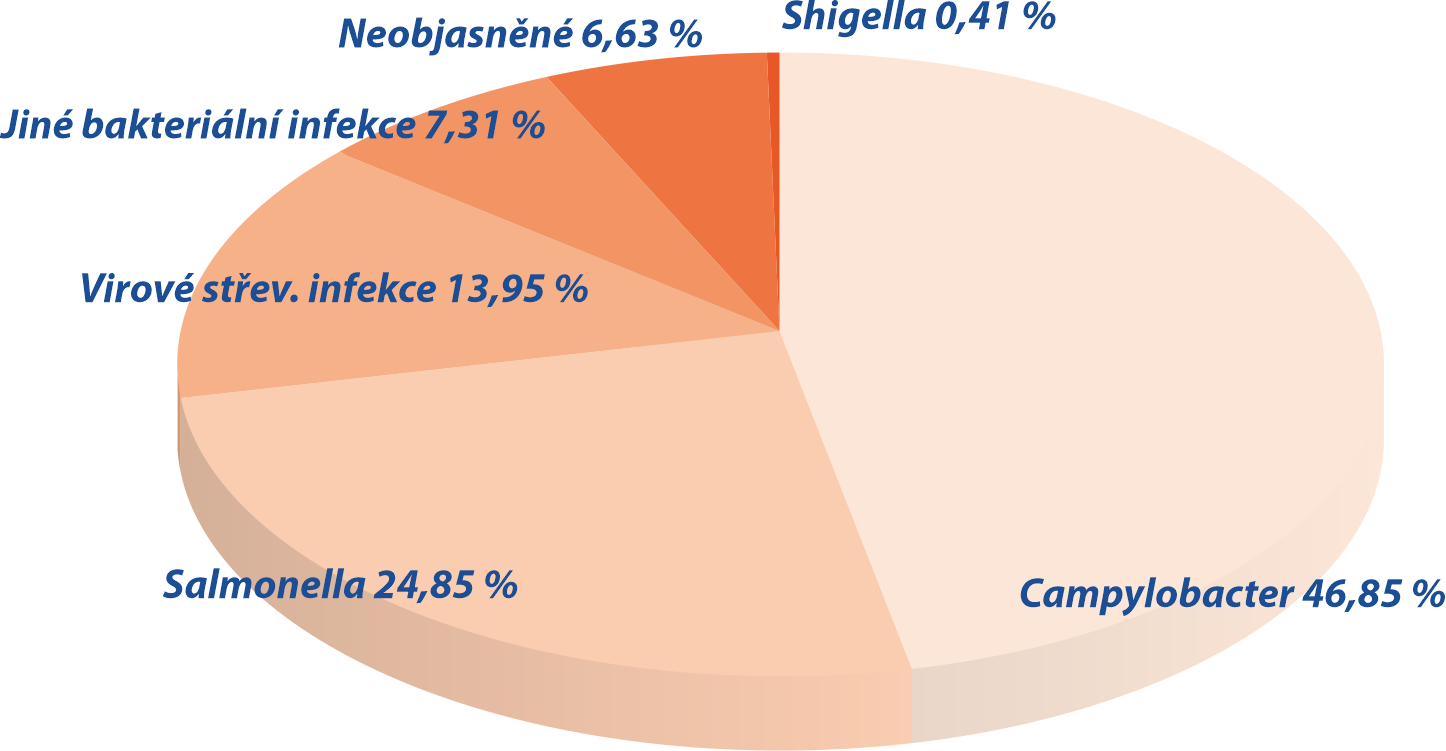

Dysbióza
Dysbióza je narušení přirozeného složení střevní mikroflóry. Muže být příčinou průjmu. Rizikové faktory a příčiny dysbiózy4:
- antibiotika
- parenterální / enterální výživa
- diabetes mellitus
- metabolické poruchy
- dráždivý tračník (IBS)
- zánětlivé onemocnění střev (IBD)
- patogeny
- vyšší věk
- stres
- špatná výživa
- kouření
Tanát želatiny
Účinný již během 12 hodin, snížení rizika dehydratace9
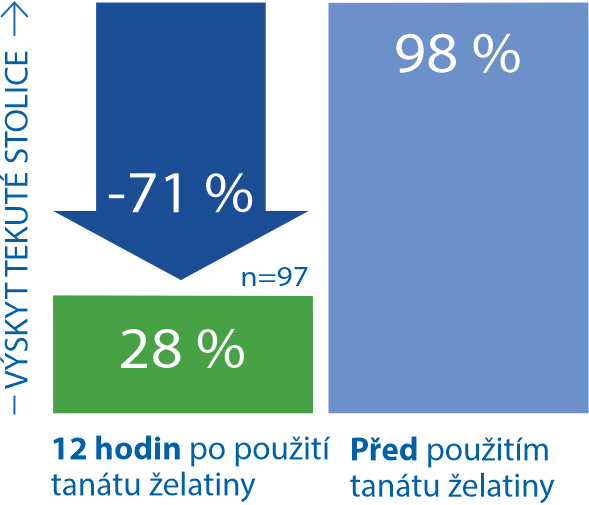
Je významně rychlejší než jiné přípravky11

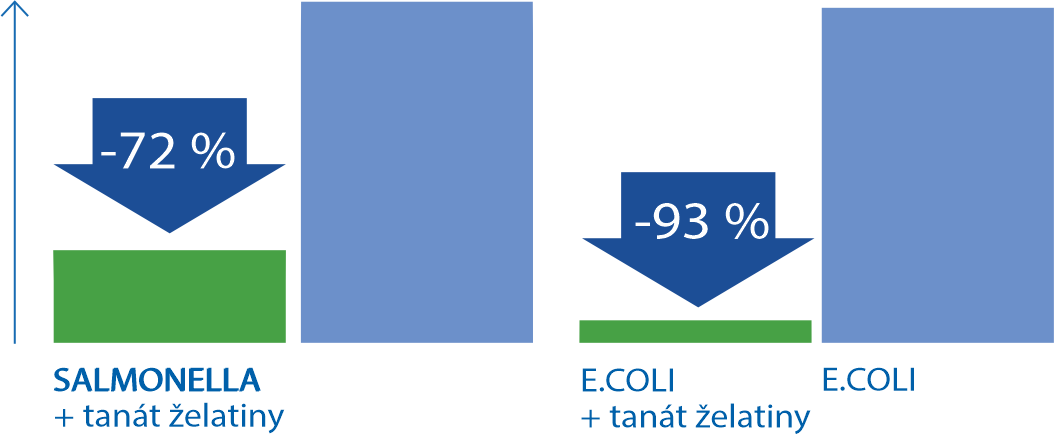
Snižuje bakteriální nálož způsobující průjem10
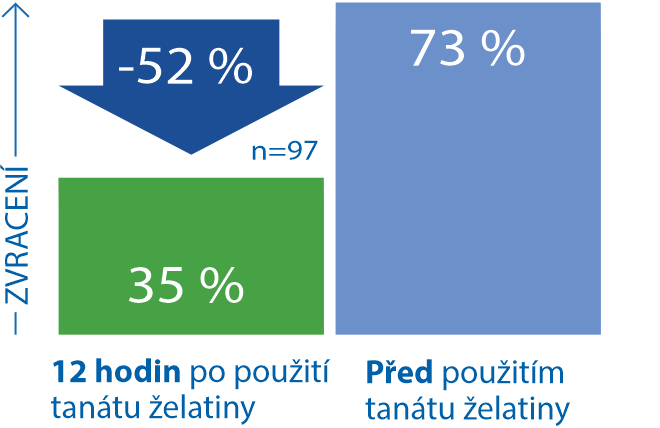
Zmírňuje nevolnosti a zvracení doprovázející průjmy9
Tyndalizovaná probiotika
Tyndalizovaná probiotika jsou účinnější než živá probiotika u chronických průjmů16
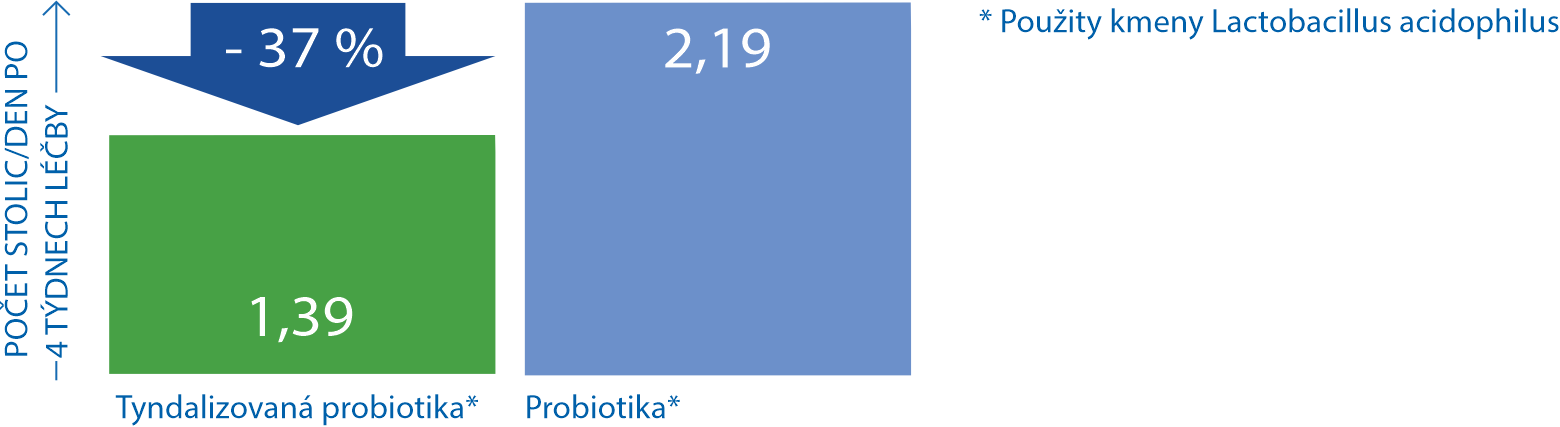
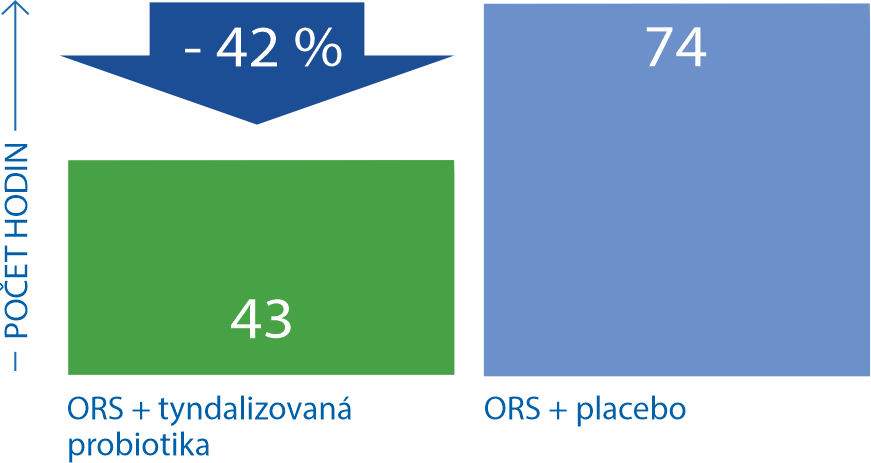
Tyndalizovaná probiotika významně zkracují délku průjmu u dětí17
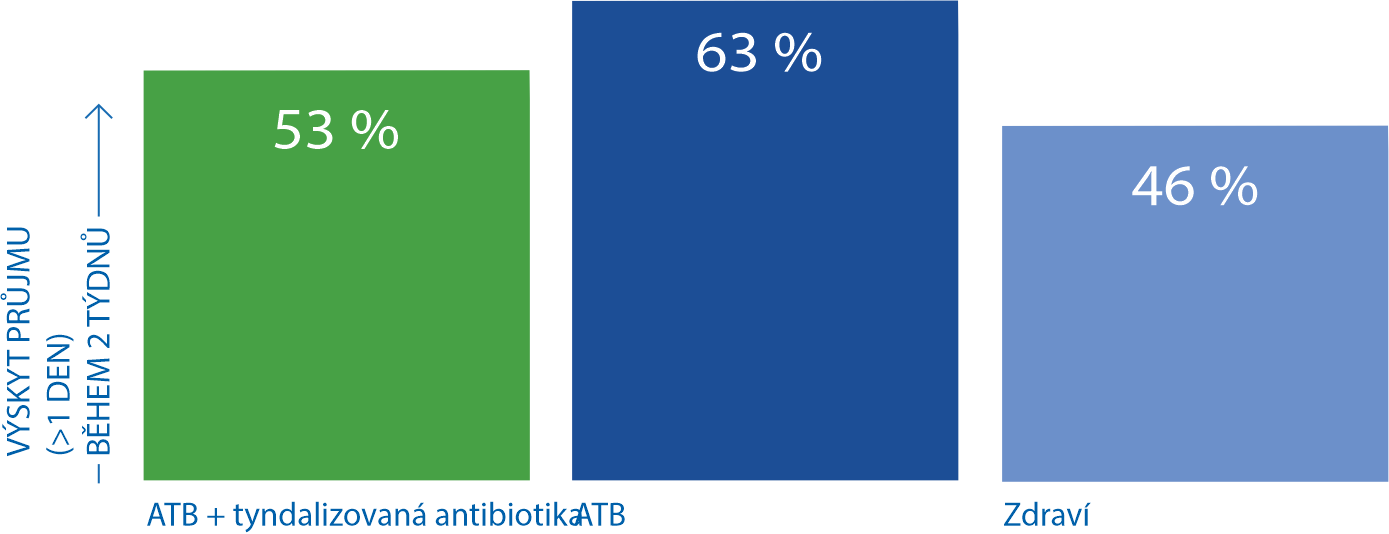
Tyndalizovaná probiotika snižují riziko výskytu průjmu při léčbě ATB18
ZDROJE:
-
Hollister EB, Gao C, Versalovic J. Compositional and functional features of the gastrointestinal microbiome and their effects on human health. Gastroenterology. 2014 May;146(6):1449-58.
Gastrointestinální trakt (GIT) člověka obsahuje pestrou mikrobiální komunitu, jejíž členové se liší složením a funkčními charakteristikami. Jejich vlastnosti jsou podmíněné místem, kde se v GIT nacházejí, věkem jedince, jeho pohlavím, rasou a výživovými zvyklostmi. Autoři popisují bakteriální kmeny přítomné v různých částech GIT a jejich specifické metabolické vlastnosti, které mohou ovlivňovat lidský organismus ve zdraví a nemoci. Přítomnost některých bakteriálních kmenů je spojovaná se zdravím a absencí nemoci. Znalosti charakteristik zdravého mikrobiomu lze využít pro cílenou prevenci nemocí a optimalizaci zdravotního stavu. -
Viggiano D, Ianiro G, Vanella G, Bibbò S, Bruno G, Simeone G, Mele G. Gut barrier in health and disease: focus on childhood. Eur Rev Med Pharmacol Sci. 2015 Mar;19(6):1077-85.
Střevní bariéra je funkční jednotka, uspořádaná do několika vrstev, tvořená dvěma hlavními složkami – mechanickou bariérou střevního povrchu, která brání adhezi bakterií a jejich paracelulárnímu průniku do organismu, a hlubší funkční bariérou, která rozliší patogeny od komenzálů a je základem pro imunitní reakci vůči patogenům, resp. imunitní toleranci vůči komenzálům. Integritu střevní bariéry dále podporují sekrety žaludku a pankreatu, které mají antimikrobiální vlastnosti. Významnými složkami střevní bariéry jsou: a) mikrobiota (soutěží s patogeny o prostor, zdroje energie, produkuje látky nezbytné pro slizniční integritu a moduluje imunologickou aktivitu hlubší vrstvy), b) hlen střevní sliznice (odděluje střevní obsah od vnitřních struktur a obsahuje antimikrobiální látky a slizniční IgA), c) střevní epiteliální buňky (tvoří mechanickou a imunologickou bariéru), d) buňky vrozené a získané imunity, které vytvářejí střevní lymfatickou tkáň (GALT). Porušení střevní bariéry je dnes spojované s mnoha nemocemi zažívací soustavy (GIT) i extraintestinálními patologiemi (diabetes mellitus 1. typu, alergie, poruchy autistického spektra). Udržování zdravé střevní bariéry je nanejvýš důležité u dětí. Mechanismus účinku mnoha látek používaných v léčbě nemocí GIT spočívá v ochraně a obnovení normální střevní permeability. Mnoho studií osvětlilo roli probiotik v modulaci a redukci intestinální permeability, s důrazem na zásadní vliv střevní mikrobioty pro fungování střevní bariéry a optimalizaci imunitních pochodů. Výzkum se dnes zaměřuje na vývoj látek, podporujících zdravou střevní mikrobiotu a střevní bariéru. -
Forstner JF. Intestinal mucins in health and disease. Digestion. 1978;17(3):234-63.
Intestinální muciny jsou komplexní glykoproteiny, syntetizované a vylučované gobletovými buňkami, které tvoří gelovitý povrch střevní mukózy. Předpokládá se, že zajišťují zvlhčování a ochranu střevních epiteliálních buněk proti potenciálním škodlivinám. Práce shrnuje poznatky na úrovni své doby o struktuře mucinů, jejich sekreci a funkcích. Krátce diskutuje využití poznatků pro léčbu onemocnění jako jsou cystická fibróza, peptický vřed, malignity a zánětlivé nemoci střev. -
Kim JJ, Khan WI. Goblet cells and mucins: role in innate defense in enteric infections. Pathogens. 2013 Feb 4;2(1):55-70. doi: 10.3390/pathogens2010055.
Gobletovy buňky, přítomné v gastrointestinálním traktu (GIT), syntetizují, skladují a vylučují ochranný hlen, složený z vysokomolekulárních glykoproteinů, které se označují jako muciny. Vrstva hlenu v GIT je dynamickou ochranou bariérou, která pokrývá buňky GIT a patří do první linie vrozené imunity. Mnohé preklinické studie prokázaly změny ve složení mucinů během zánětlivých stavů GIT a zvýšenou sekreci hlenu jako reakci na infekce. Muciny jsou prvními molekulami, které neutralizují invazivní patogeny. Muciny interagují s patogeny na povrchu epitelií a brání jejich vazbě na glykoproteiny buněčných membrán. Práce přinesla souhrn poznatků o odpovědi gobletových buněk na různé infekční inzulty v GIT a o regulační síti, která ovlivňuje funkce gobletových buněk a produkci mucinů. Dále popisuje současné znalosti o úloze mucinů ve střevní vrozené imunitě. -
Hodges K, Gill R. Infectious diarrhoea: Cellular and molecular mechanisms. Gut Microbes. 2010 Jan;1(1):4-21.
Infekční střevní průjmy jsou významným faktorem celosvětové morbidity a mortality. Z ročního odhadovaného počtu 2-4 miliard průjmových onemocnění postihuje značná část malé děti. Review se zabývá celulárními a molekulárními mechanismy průjmů, spojených s bakteriálními, virovými a parazitárními infekcemi. Jako modelové příklady bakteriálních průjmů autoři vybrali Vibrio cholerae, Clostridium difficile, Shigella sp. a patogenní Escherichia coli. Mnohé experimentální studie se zabývají epiteliálním transportem iontů a funkcemi střevní bariéry při infekcích viry a parazity. Autoři práce se zaměřili na virové průjmy vyvolané rotaviry, noroviry a astroviry. Jako příklady parazitických průjmů jsou diskutovány infekce Giardia lamblia a Entamoeba histolytica. Paraziti jsou schopní produkovat molekuly podobné látkám hostitelského organismu, jako např. serotonin a PGE2. Patogenetické mechanismy infekčních průjmů zahrnují poškození transportu iontů a těsných spojů (tight junctions), faktory virulence a neurotransmitery. -
Moré MI, Swidsinski A. Saccharomyces boulardii CNCM I-745 supports regeneration of the intestinal microbiota after diarrheic dysbiosis – a review. Clinical and Experimental Gastroenterology. 2015;11:237-255.
Probiotická plíseň Saccharomyces cerevisiae HANSEN CBS 5926 (Saccharomyces boulardii CNCM I-745) se využívá pro prevenci a léčbu průjmu. Mechanismus působení spočívá v několika faktorech, jako jsou imunologické účinky, vazba na patogeny, protitoxinový efekt a účinek na trávící enzymy. Díky vrozeným vlastnostem je S. boulardii schopná vytvořit příznivé podmínky pro růst zdravé střevní mikrobioty, chránit intestinální hlen a střevní mukózu. Práce se zaměřila na pozitivní vliv S. boulardii na složení střevní mikroflóry při dysbiózách. -
Bermudez-Brito M.et al. Probiotic Mechanisms of Action. Ann Nutr Metab 2012;61:160-174.
Probiotika jsou živé mikroorganismy, které mají pozitivní zdravotní účinky pro hostitele, pokud jsou užívána v adekvátním množství. Nejčastěji užívanými probiotickými kmeny jsou mléčné bakterie a bifidobakterie. Probiotika mají prokázaný potenciál pro léčbu řady chorob, ale přesný mechanismus jejich účinku není dodnes objasněný. Známá je jejich schopnost: a) modifikovat střevní mikrobiotu, b) kompetice s patogeny v adherenci na střevní mukózu, c) posilovat epiteliální bariéru a d) pozitivně modulovat imunitní systém. Stoupající počet poznatků přináší další informace. Probiotika mají schopnost „komunikovat“ s hostitelem pomocí různých receptorů, např. toll-like receptorů, receptorů různých bílkovin, modulací klíčových buněčných signálních drah (např. nuclear factor-kappa B, mitogen-activated protein kinase). Tyto poznatky mají důležitou roli pro pochopení jejich antimikrobiálních schopností při minimálním zánětlivém poškození tkáně. Porozumění mechanismům účinků probiotik povede k výběru specifických kmenů pro konkrétní klinické situace. -
Frasca G, Cardile V, Puglia C, Bonina C, Bonina F. Gelatin tannate reduces the proinflammatory effects of lipopolysaccharide in human intestinal epithelial cells. Clin Exp Gastroenterol. 2012;5:61-67.
Tanát želatiny je kombinací taninu (tříslovin) a želatiny. Tanin má účinky adstringentní (má schopnost vytvářet proteinové makromolekulární komplexy), antibakteriální a antioxidační. Práce si dala za cíl zhodnotit jeho účinky protizánětlivé. Šlo o in vitro studii s buňkami Caco-2 (Pozn. překladatele: Caco-2 buňky jsou buněčnou linií odvozenou z kolorektálního adenokarcinomu. Jejich charakteristickým znakem je spontánní diferenciace s vytvořením monovrstvy s plně diferencovanými a polarizovanými buňkami s typickým kartáčovým lemem a těsnými spoji, a to za normálních kultivačních podmínek.). Caco-2 buňky byly vystavené působení bakteriálního polysacharidu (LPS), který vyvolal v buňkách zánětlivé procesy a sekreci zánětlivých cytokinů. Po 24 hodinách byly v médiu měřené exprese a/nebo koncentrace zánětlivých cytokinů (ICAM-1, IL-8, TNF-α) po přidání různých koncentrací tanátu želatiny. Tanát želatiny výrazně blokoval expresi ICAM-1. Sekreci IL-8 a TNF-α blokoval tanát želatiny různě, v závislosti na jeho množství v médiu. Autoři uzavřeli studii tak, že tanát želatiny má výrazné protizánětlivé účinky prostřednictvím inhibice specifických cytokinů a adhezních molekul. -
Esteban Carretero J, Durbán Reguera F, López-Argüeta Alvarez S, López Montes J. A comparative analysis of response to ORS vs. ORS + gelatin tannate in two cohorts of pediatric patients with acute diarrhea. Rev Esp Enferm Dig. 2009;101:41-48.
Observační studie na pediatrické populaci (3 měsíce až 12 let). Děti s akutním průjmem, který netrval déle než tři dny. Cílem bylo zhodnocení účinnosti orální rehydratace (ORS) ve srovnání s kombinací ORS + tanát želatiny. Primární endpoint – počet stolic za 12 hodin od začátku léčby ve srovnání s výchozím stavem (baseline). Další sledované parametry – tělesná hmotnost, horečka, zvracení, charakter stolice, známky peritonitidy/sepse. Tanát želatiny + ORS statisticky významně snížil počet stolic už za 12 hodin od zahájení terapie a normalizoval konzistenci stolice. I další sledované parametry se zlepšily nebo vymizely. -
L. Bueno. Mechanisms involved in bacterial pathogen-induced intestinal mucosal barrier disruption: Therapeutic interest of mechanical protection of epithelial tight junction (TJ). Oral communication. Sofia, June 13, 2014.
In vitro průkaz účinnosti tanátu želatiny. Studie s jednou vrstvou buněk CacoGoblet, které byly inkubované s tanátem želatiny nebo neúčinným vehikulem. Po 4 hodinách inkubace byly buňky infikované bakterií Salmonella typhimurium. Po dvou hodinách od infekce se měřil průnik bakterií přes těsné spoje mezi CacoGoblet buňkami. Tanát želatiny (na rozdíl od vehikula) zabránil průniku bakterií S. typhimurium paracelulárně. -
Serban ED, Manolache M. Gelatin tannate versus other antidiarrheal medication in children with acute gastroenteritis: a retrospective, observational study. J Comp Eff Res. 2019;8(3):187-194.
Retrospektivní, observační studie u dětí (6 měsíců až 7,9 roku) s akutní gastroenteritidou. Cílem bylo zhodnocení terapeutické účinnosti tanátu želatiny. Děti byly léčené buď tanátem želatiny, nebo jiným protiprůjmovým prostředkem. Hodnotil se počet stolic a jejich konzistence. Tanát želatiny zkrátil trvání průjmu průměrně na 29 hodin (ostatní protiprůjmové prostředky na 45,4 hod.), p<0,0001. Tanát želatiny normalizoval konzistenci stolice za 72 hodin u 87 procent malých pacientů (ostatní antidiarhoika jen u 30,4 %); p=0,026. Rozdíly v účinnosti mezi tanátem želatiny a jinými protiprůjmovými prostředky byly patrné už po 12 hodinách. -
Aloi M, Mennini M. Efficacy of gelatin tannate for acute diarrhea in children: a systematic review and meta-analysis. J Comp Eff Res. 2019;8(2):91-102.
Metaanalýza tří randomizovaných, kontrolovaných studií s tanátem želatiny (střevní mukoprotektor) u dětí (0-12 let) s akutní gastroenteritidou. Tanát želatiny statisticky významně snížil počet stolic během prvních 12 hodin léčby a rychle normalizoval jejich konzistenci. -
Lopetuso LR et al. The therapeutic management of gut barrier leaking: the emerging role for mucosal barrier protectors. Eur Rev Med Pharmacol Sci 2015;19:1068-1076.
Střevní bariéra je mnohovrstevná funkční jednotka, která hraje jednu z klíčových rolí pro udržení intestinální homeostázy. Četné publikace prokázaly souvislost mezi narušením střevní bariéry (které vede k průniku střevního obsahu paracelulárně do hlubších vrstev a krve a aktivaci imunitní odpovědi a zánětu) a chorobami zažívacího traktu (nespecifické střevní záněty, sy bakteriálního přerůstání, dráždivý tračník, jaterní cirhóza) i mnoha extraintestinálními patologiemi (atopie, …). Review se zabývá: a) vztahem mezi narušenou střevní bariérou a lidským zdravím, b) možnostmi nových střevních mukoprotektorů (např. tanátu želatiny) v posílení a obnovení fyziologické střevní bariéry. -
Wassenaar TM, Klein G. Safety aspects and implications of regulation of probiotic bacteria in food and food supplements. Journal of Food Protection 2008;71 (8): 1734-1741.
Používání živých probiotických kmenů v potravinách nebo doplňcích stravy vyžaduje pečlivé hodnocení jejich bezpečnosti. Práce sumarizuje poznatky o rizicích živých probiotik, využívaných pro posílení zdraví nebo léčbu infekcí. Není totiž jednoduché absolutně vyloučit jakékoli faktory virulence živých probiotik. U živých probiotik může docházet k horizontálnímu přenosu genetické informace, včetně genů bakteriální rezistence vůči antibiotikům. Tyto geny se pak mohou nekontrolovaně šířit i v normální střevní bakteriální populaci. Autoři také shrnují požadavky na bezpečnost probiotik vyžadované v USA a Evropské Unii. - Lékárenské desatero o probioticích. FarmiNews 1/2009, p. 8-9.
-
Xiao SD et al. Multicenter, Randomized, Controlled Trial of Heat-Killed Lactobacillus acidophilus LB in Patients With Chronic Diarrhea. Adv Ther. 2003;20(5):253-60.
V patogenezi chronického průjmu hraje významnou roli poškození fyziologické střevní mikroflóry. Klinická studie hodnotící účinnost lyofilizované tyndalizované bakterie Lactobacillus acidophilus LB ve srovnání s živými laktobacily v terapii chronického průjmu. Randomizovaná studie, která trvala 4 týdny. Zaznamenávala se četnost stolic, jejich konzistence, bolesti břicha, distenze a pocity neúplného vyprázdnění. Tyndalizované bakterie byly v léčbě účinnější než živé laktobacily. -
Simakachorn N et al. Clinical Evaluation of the Addition of Lyophilized, Heat-Killed Lactobacillus acidophilus LB to Oral Rehydration Therapy in the Treatment of Acute Diarrhea in Children. J Pediatr Gastroenterol Nutr. 2000;30(1):68-72.
Randomizovaná, placebem kontrolovaná studie hodnotící účinnost tyndalizované lyofylizované bakterie Lactobacillus acidophilus LB v kombinaci s orální rehydratací (ORS) v léčbě dětí (3-24 měsíců) s akutním průjmem (včetně antibiotických průjmů). Po 24 hodinách měly děti léčené tyndalizovaným laktobacilem podstatně nižší počet stolic ve srovnání s placebovou skupinou. Průjem v aktivně léčené skupině trval průměrně 43,4 hod., v placebové skupině 57 hod. -
Yap Soo KJA et al. LACTEOL FORT TREATMENT REDUCES ANTIBIOTIC ASSOCIATED DIARRHEA. SFP2010;36(4):46-49.
Léčba antibiotiky je často provázená nežádoucími zažívacími účinky, včetně průjmu. Probiotika se využívají při prevenci a léčbě antibiotických průjmů. Prospektivní kontrolovaná studie hodnotící účinnost tyndalizovaného laktobacila v terapii antibiotických průjmů u dospělých v primární péči. Tyndalizované probiotikum dovedlo účinně zabránit rozvoji antibiotického průjmu.